의료기기, 의료용 부품
페이지 정보

본문

<도입시기>
2018
<근거 규정>
인도네시아 보건부 규정 No.62/2017
<제도 내용>
NIE(Nomor Izin Edar, 유통허가번호)는 인도네시아 보건부에서 발급하는 공식 등록번호이자 허가증으로서 인도네시아내에서 제조, 수입, 유통을 하고자하는 모든 의료기기에 필수적으로 적용된다.
이 제도는 제품이 환자, 사용자 그리고 환경에 미치는 위험 수준에 따라 위험 등급(Class 1A ~ Class 3D)을 나누어 평가하며 등급이 높을수록 허가 심사 절차가 세밀하게 검토된다.
<품목정의>
인도네시아 보건부 규정 No.62/2017에 따른 하위 제품군
ㅇ 의료기기
ㅇ 체외진단기기
ㅇ 가정용 위생용품(PKRT)
<적용대상품목>
인도네시아 내에서 생산, 수입, 조립, 재포장, 유통, 판매되는 모든 의료기기, 체외진단기기, 가정용 위생용품
<확대적용품목>
<인증절차>
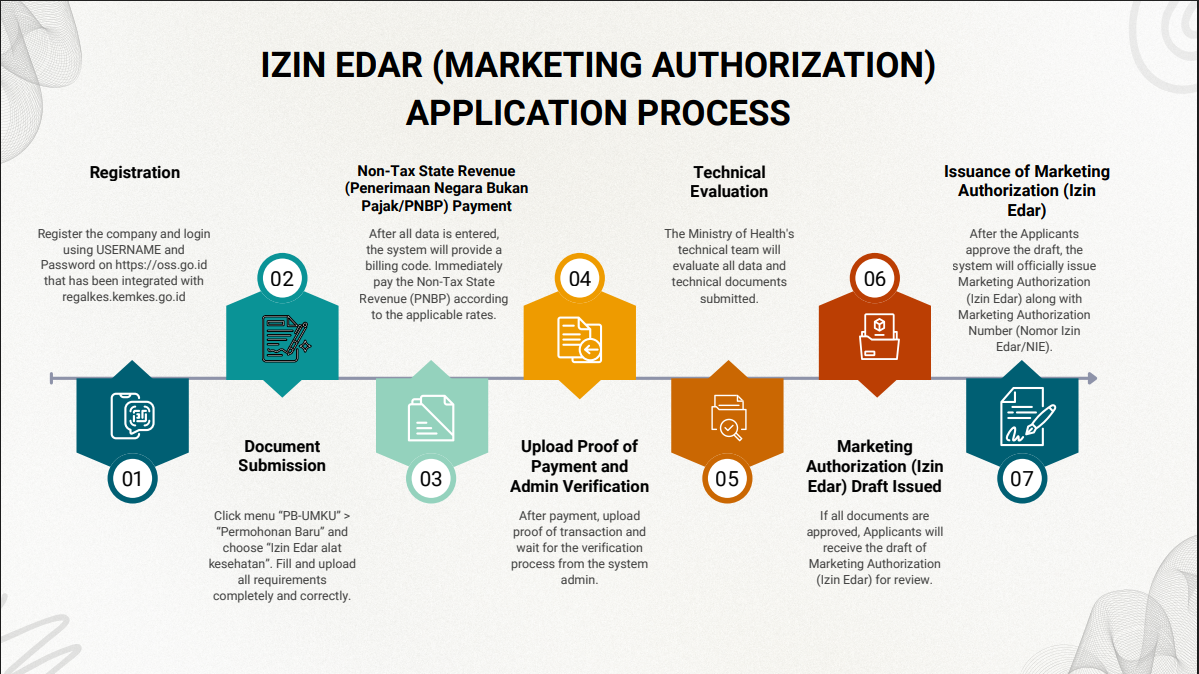
1. 인도네시아 현지 법인 설립 또는 유통업체 발굴
- 법인 또는 유통업체에서 IDAK(의료기기 유통 허가증), CDAKB(의료기기 우수 유통 관리 기준 인증서) 획득 필요
2. 라이센스 ID 발급
- 인도네시아 정부 운영하는 사업 허가 라이센스 발급 사이트(oss.go.id) 통해 현지 법인 또는 대리인(유통업체)의 ID 발급
* 상기 ID가 있어야만 보건부에 인증 심사 서류 제출 가능
3. 인증 심사 서류 및 심사 수수료(PNBP 수수료) 납부 증빙 업로드
- 의료기기 등급에 따라 맞는 심사 서류(신청서 및 양식 A~E)와 심사 수수료(PNBP) 납부 증빙 업로드
* 기준에 부적합한 서류를 업로드했을 경우 1회 보완 자료 제출 기회가 부여되며 평가 결과로부터 10~15일내 재업로드 필요
- (제출처) : https://regalkes.kemkes.go.id/
* 라이센스 ID 발급처인 oss.go.id 통해 접속 연동
4. 유통 허가증 발급
- 등록된 제품이 인도네시아 보건부 규정에 부합할 경우, 허가증이 발급됨
- 허가증의 유효기간은 최대 5년이며, 만료 9개월 전부터 갱신 신청 가능
<시험기관>
인도네시아 보건부(Kemenkes) 의약품 의료기기 총국
<인증기관>
인도네시아 보건부(Kemenkes) 의약품 의료기기 총국
<유의사항>
인증획득 절차
<구분>
인증기관 #1
<기관 명>
인도네시아 보건부(Kemenkes) 의약품 의료기기 총국
<홈페이지>
<담당부서>
<전화번호>
+62-21-5292-1480
+62-21-5292-1480
<팩스번호>
<이메일>
inspeksi.alkes@kemkes.go.id
<기타>
<구분>
시험기관 #1
<기관 명>
인도네시아 보건부(Kemenkes) 의약품 의료기기 총국
<홈페이지>
<담당부서>
비용·소요기간
<구분>
시험
<시험규격 혹은 시험항목>
<시험 비용>
<소요 기간>
<구분>
인증
<초기공장심사 비용>
<인증 비용>
ㅇ 신규 등록 의료기기 등급별 심사수수료
- Class 1A: IDR 1,500,000
- Class 2B/2C : IDR 3,000,000
- Class 3D : IDR 5,000,000
ㅇ 갱신 또는 변경에 대한 의료기기 등급별 수수료
- Class 1A : IDR 500,000
- Class 2B/2C : IDR 1,000,000
- Class 3D : IDR 1,000,000
ㅇ 갱신 및 변경에 대한 의료기기 등급별 수수료
- Class 1A : IDR 1,000,000
- Class 2B/2C : IDR 1,500,000
- Class 3D : IDR 1,500,000
<소요 기간>
ㅇ (신규 등록 기준) 업무일 기준 45일 ~ 120일 소요
- Class 1A : 45일
- Class 2B/2C : 90일
- Class 3D : 120일
<인증 유효기간>
최대 5년(갱신 가능)
<사후관리 비용>
<자료원>
인도네시아 보건부(Kemenkes) 의약품 의료기기 총국(https://regalkes.kemkes.go.id/)
유의사항
<필요 서류>
1) Application Form(신청서) : 사업자등록증(NIB), 제품 정보, 공장 정보 등
2) Form A(Administrative Requirements, 행정 서류)
ㅇ 생산증명서(현지생산제품만)
ㅇ 유통증명서(IDAK)
ㅇ 위임장(수입제품용)
ㅇ 자유판매증명서(CFS, 수입제품용)
ㅇ 제품 인증서 (ISO 9001, ISO 13485, CE 등)
ㅇ 제품 요약 설명
ㅇ 표준 적합성 선언서
ㅇ 상표권 및 특허 등록증
ㅇ 제출 문서 진위 선언서
3) Form B(Product information requirements, 제품 정보 서류)
ㅇ 의료기기 설명서 및 특징
ㅇ 사용 목적
ㅇ 적응증(Indication)
ㅇ 사용 지침
ㅇ 사용 목적
ㅇ 금기증(Contraindication)
ㅇ 경고 및 주의사항
ㅇ 예상 부작용
ㅇ 대체요법
ㅇ 재료
ㅇ 제조사 정보
ㅇ 생산 프로세스
4) Form C(Specification and Quality assurance, 사양 및 품질 보증 서류)
ㅇ 제품 기술 사양 및 성능
ㅇ 제품 설계 검증 및 유효성 보고서
ㅇ 비임상 시험 데이터
ㅇ 소프트웨어 유효성 평가 보고서(소프트웨어 적용 품목 한정)
ㅇ 생물학적 안정성 시험 보고서
ㅇ 임상 평가 보고서
ㅇ 위험 분석 (D Class 필수)
ㅇ 주요 부품 및 원료 사양
ㅇ 포장 사양
ㅇ 성능 테스트 결과
5) Form D(labelling Requirements, 라벨링 서류)
ㅇ 제품 라벨 사본
ㅇ 패키징 기호 목록 및 설명
ㅇ 사용 설명서(인니어, 영어)
ㅇ 생산 코드
ㅇ 악세사리 목록
6) From E(Post-Market Evaluation Requirements, 사후 관리 계획 서류)
ㅇ 사후 관리 계획(불만 처리, 부작용 보고, 제품 회수 등)를 위한 절차 서류 (B,C,D Class 필수)
<유의 사항>
인증에 필요한 서류는 정부 부처 정책에 따라 변동될 수 있으므로 상세 문의는 KOTRA 자카르타 무역관에 상담 문의 요망
<기타>
<첨부 파일>
<저작권자 : ⓒ KOTRA & KOTRA 해외시장뉴스>
관련링크
댓글목록
등록된 댓글이 없습니다.